El inmunólogo y biólogo neerlandés, galardonado con el Abarca Prize, desarrolló estos órganos en miniatura, cultivados a partir de células madre adultas, para impulsar el desarrollo de tratamientos más precisos y eficaces Leer El inmunólogo y biólogo neerlandés, galardonado con el Abarca Prize, desarrolló estos órganos en miniatura, cultivados a partir de células madre adultas, para impulsar el desarrollo de tratamientos más precisos y eficaces Leer
Para Hans Clevers (Eindhoven, Países Bajos, 1957) investigar es como «sacudir un manzano y recoger las manzanas que caen del árbol». En su experiencia, esa estrategia obtiene mejores resultados que el consabido método científico de proponer una respuesta hipotética a un problema. A la vista está que el método que ha mantenido Clevers fructifica. Sus hallazgos le han llevado a transformar la manera en que se estudian y se manejan las enfermedades, gracias al desarrollo de los organoides, miniaturas que reproducen en el laboratorio las estructuras y las funciones de múltiples órganos humanos.
El médico y biólogo neerlandés ha sido reconocido con el ‘Abarca Prize‘, el Premio Internacional de Ciencias Médicas Doctor Abarca, un galardón nacido en 2021 con el propósito de realzar ante la sociedad los avances médico-científicos. Clevers es profesor de Genética Molecular en la Universidad de Utrecht, impulsor del Instituto de Biología Humana (IHB) -centro que traslada los avances de la tecnología de organoides a la práctica clínica-, anteriormente director de Investigación Farmacéutica y Desarrollo Temprano de Roche (pRED) y, hasta hace poco, miembro de su Comité de Dirección.
En una entrevista con motivo de la entrega del premio, agradece el «gran honor» que supone el reconocimiento y lo hace extensivo a los científicos que han trabajado en su laboratorio a lo largo de varias décadas, aportando «contribuciones clave».
Reconoce que la tecnología de los organoides es aún muy joven, si bien detalla qua su aplicación ha demostrado que puede mejorar el tratamiento de los pacientes con fibrosis quística y que puede ser útil para afinar en las terapias del cáncer, evitando toxicidades innecesarias. Espera también que su uso permita realizar ensayos clínicos más exitosos, que lleven a buen puerto a un mayor número de nuevos fármacos.
- ¿Cómo explica usted lo que es un organoide? A menudo nos referimos a ellos como «miniórganos», aunque puede que no sea exacto.
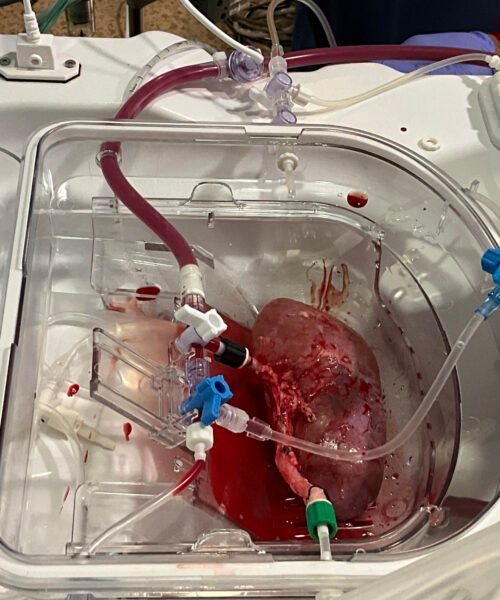
- Veamos, mientras estoy aquí sentado, la mayor parte de mi cuerpo es capaz de repararse a sí mismo. Por ejemplo, cada día, las células madre de la médula ósea producen células sanguíneas o las células madre de la piel producen piel. Todo empezó cuando descubrimos las células madre en el intestino. Nos dimos cuenta de que no se comportaban como decían los libros de texto. Esto llevó a plantearnos si podríamos extraer esas células madre, que entonces eran de ratón, ponerlas en una placa de Petri, recrear el entorno en el que viven y ver qué hacían. Esperábamos que crecieran, pero ocurrió algo sorprendente: empezaron a construir una estructura, que era como una pequeña copia del tejido del que procedían. Por eso, al principio lo llamamos mini-intestino. Hemos visto que se puede lograr lo mismo muchos otros órganos y los llamamos organoides, es decir, similares a órganos. Son muy pequeños y no tienen vasos sanguíneos, ni nervios, ni células inmunitarias, aunque se les pueden añadir. Sin embargo, en su forma básica, son solo células hepáticas, pulmonares o intestinales, pero consiguen crear todos los diferentes tipos de células de un órgano. Por ejemplo, en el intestino hay doce tipos de células, y los doce están en el organoide.
- ¿Por qué suponen un avance tan importante en el campo biomédico?
- Porque antes de los organoides, utilizábamos dos formas de estudiar a las células vivas: las líneas celulares, típicamente del cáncer, como las células HeLa [obtenidas del cáncer de cérvix de una paciente], que se podían cultivar bien en el laboratorio, y han sido el caballo de batalla para la investigación en desarrollo de fármacos durante décadas. Y la otra opción eran los animales de laboratorio. Así que los organoides suponen una nueva entidad, son mejores que las líneas celulares, al proceder de células no tumorales, normales, y son humanos. Con respecto a los animales de laboratorio son más simples de obtener, pero también es necesario en investigación contar con la complejidad de un organismo completo, como un ratón. Ahora se está impulsando el uso de organoides, si bien durante un tiempo coexistirán con los animales de laboratorio. No obstante, los organoides podrán sustituir a otros modelos experimentales en muchas cosas, por ejemplo, en los estudios iniciales de seguridad, en la evaluación de la toxicidad, en la determinación del metabolismo de los fármacos y cuál es la mejor vía de administración. Todo lo que se hace en farmacología se puede aplicar a los modelos organoides. Pero dicho esto, aún queda mucho por desarrollar, porque se trata de una tecnología muy joven.
- ¿Cree posible que los organoides no hagan necesaria las fases 1 de los ensayos?
- Lo que esperamos es que los organoides sean mucho más predictivos que los animales y que, aunque siga siendo necesario realizar la fase 1, la tasa de éxito sea mucho mayor en esta fase, que haya menos toxicidad y riesgo para los pacientes o voluntarios que participan en el ensayo de fase 1. También que un mayor porcentaje de fármacos superen esa fase 1, porque ahora tenemos muchos fracasos ahí. Hacemos experimentos con animales y, aun así, en la fase 1 siempre hay sorpresas. Si se hace todo en modelo humano, es lógico pensar que nos darán un mejor punto de partida para un ensayo de fase 1.
- ¿Qué órgano sería más difícil de modelar con esta tecnología?
- Hoy la mayoría de tejidos del cuerpo humano adulto pueden cultivarse con ella. En los que no tienen células madre, como el músculo cardíaco o el cerebro, se puede recurrir a las células madre embrionarias o a las células iPS [de pluripotencialidad inducida], y, básicamente, darles instrucciones para que recreen las células madre del órgano. Aunque es un camino mucho más largo, puede llevar meses. Desde luego, el cerebro humano es el más complejo de recrear. No creo que haya nada en este universo tan complejo. Aunque el intestino también tiene su complejidad. Nosotros hemos trabajado mucho con el intestino, que desde un punto de vista evolutivo, es un órgano antiguo, presente en todos los animales; probablemente, se necesiten muchos científicos y años para perfeccionar su organoide.
- Y teniendo en cuenta esa complejidad, ¿ve posible que se obtengan organoides de cerebros capaces de pensar o de ser conscientes?
- No soy neurocientífico, pero hoy lo veo muy lejano. Podemos cuestionarnos si esto va a suceder o no, pero aunque los científicos digan que no hay motivo para preocuparse, sigue siendo importante abordarlo y debatirlo. Muchas de las cosas que hacemos en biología plantean cuestiones éticas, pasa también con la investigación en embriones humanos. Además, más allá del cerebro, otras cuestiones éticas que también podemos plantearnos con los organoides es ¿de quién son? Si te doy algo de mi piel para hacerlo, ¿es mío? ¿Es del instituto? Si quiero crear una empresa biotecnológica, ¿puedo trabajar libremente con él? Por eso, los consentimientos informados son muy importantes. Pero los estudios biomédicos plantean cuestiones éticas casi de inmediato.
- ¿Cuál es el papel de los organoides en la medicina personalizada?
- Es una de sus aplicaciones, pero aún queda mucho por hacer. La medicina personalizada busca saber si un paciente concreto responderá a un fármaco determinado. Así los hemos utilizado con mucho éxito en la fibrosis quística. Desarrollamos los primeros organoides en torno a 2009, y unos años más tarde, trabajamos con el Hospital Infantil de Utrecht, que tiene un centro para la fibrosis quística. Solo había un fármaco que trataba esta enfermedad, que actuaba en la mitad de los pacientes, con una mutación concreta. En la mitad restante, para saber si el tratamiento funciona es necesario administrarlo durante mucho tiempo, lo que limitaba el acceso de los pacientes al fármaco. Entonces, el Centro de Fibrosis Quística se puso en contacto con nosotros y nos preguntó si podíamos pensar en una prueba con organoides. Lo preparamos todo y realizamos organoides de colon a partir de la biopsia rectal de los pacientes. Así desarrollamos una prueba para validar el tratamiento, y de esta forma sabíamos que si al añadir el fármaco restaura la función del gen CFTR [codificador de la proteína reguladora de la conductancia transmembrana de la fibrosis quística], el paciente respondería. En Países Bajos, probablemente tengamos en un biobanco a casi todos los pacientes con fibrosis quística, unos 1.500 pacientes. Y todos los que querían someterse a pruebas lo han hecho. Y eso ha dado lugar a que un número significativo de pacientes que no habrían tenido fármaco, al recurrir a la prueba con organoide, lo han podido recibir. Ahora, hay otro fármaco que abarca a más pacientes, pero la prueba con organoides ha sido muy importante. Y en el caso del cáncer puede hacerse exactamente lo mismo.
- ¿Cómo?
- Se puede cultivar el tumor y exponerlo a diversos medicamentos y luego ver cuál mata el tumor y cuál no. Sabemos que solo un 40%, en general, de los pacientes con cáncer responden al tratamiento de primera línea. Si se empieza a administrar un medicamento contra el cáncer y no funciona, los pacientes sufren los efectos secundarios y el tumor sigue creciendo. Se pierde tiempo. La cuestión es que para el cáncer ya hay muchos tratamientos buenos. No se le puede decir al oncólogo que no trate como hace normalmente, pues las guías clínicas ya indican en qué casos deben utilizar cada fármaco. No obstante, ya tenemos entre 50 y 60 estudios que demuestran que los organoides tumorales son muy predictivos. El 80% predicen correctamente si un paciente responderá o no al tratamiento, y contribuir así a administrar un medicamento que sabes que va a funcionar. Pero esto llevará tiempo. No es un ensayo fácil y todavía no hay una automatización. En el caso de la fibrosis quística es factible porque el número de pacientes es bajo, hay unos 50 pacientes al año en Holanda, pero tenemos 150.000 pacientes con cáncer al año. Necesitas instrumentos automatizados, técnicos especializados.
- Su carrera es un buen ejemplo de puente entre investigación académica y desarrollo farmacéutico. A nivel global, ¿en qué punto ve que está la innovación científica en Europa?
- Si nos fijamos solo en las cifras, está claro que la mayor parte de la innovación proviene de Estados Unidos y, cada vez más, de China. Sin embargo, la ciencia académica en Europa es excelente, pero nos resulta muy difícil traducirla. Yo soy un investigador académico. He trabajado durante 40 años en este campo y he fundado varias empresas, y he visto lo difícil que es llevar a la práctica los avances. Casi todo el conocimiento importante proviene del mundo académico, de las universidades; es el punto de partida para desarrollar un medicamento, una prueba o algo similar, y ese desarrollo resulta muy difícil en Europa. Hay todo tipo de preocupaciones sobre el dinero público y luego en las empresas privadas, sobre la ética y el manejo de los datos clínicos de pacientes, que es muy complicada. Quizá con eso exageremos en Europa. Somos muy buenos regulando. La IA es un buen ejemplo, estamos muy por detrás de China y de Estados Unidos, pero nos enorgullecemos de ser los mejores reguladores de la IA. Es importante regular, pero creo que a menudo nos impide innovar. Y nos disparamos en el pie, porque realmente la ciencia en Europa es muy buena.
- Tengo entendido que el descubrimiento de los organoides fue un tanto casual, ¿es cierto?
- Sí, es cierto. Todo es cuestión de azar. Así es la forma en que hemos trabajado; mi laboratorio ha trabajado de forma muy diferente a lo que se considera el método científico clásico de pregunta, formular una posible respuesta o hipótesis y comprobarla. Aquí no tenemos hipótesis. Esto me lo recordaba, por cierto, Eduard Batlle que ahora está en Barcelona [es profesor de ICREA en el IRB Barcelona], quien ha sido un investigador muy importante en nuestro trabajo, y probablemente, es uno de los mejores científicos ahora en España. Hablaba con él la semana pasada en Alemania y me recordó que una vez hablando de hipótesis le dije ‘tenemos manzano, lo sacudimos y recogemos las manzanas que caen del árbol’. Establecemos un sistema y luego lo recogemos por todos lados e intentamos ver el patrón, sin tener una idea en mente, porque según mi experiencia, normalmente te equivocas. Como yo era inmunólogo, estudiábamos los linfocitos T, y, por casualidad, descubrimos un principio, la vía de señalización Wnt, un mecanismo crítico del desarrollo celular que nos llevó a ver su importancia en el intestino, en el cáncer de colon, en concreto, y así empezamos a trabajar en el intestino. Elegimos una de esas manzanas.
- Eso implica también investigar campos que a lo mejor no están de moda.
- Lo cierto es que procuro alejarme de los lugares donde hay mucha gente trabajando, porque los científicos tienden a ir todos en la misma dirección. Así que suelo dirigir a mi gente hacia otra dirección. Lo cual es incómodo, porque no sabes mucho, no tenemos experiencia. Por ejemplo, trabajamos en organoides de glándulas de veneno de serpiente. He aprendido que cada año, medio millón de personas mueren o pierden extremidades a causa de las mordeduras de serpiente. Y no hay investigaciones sobre las mordeduras de serpiente, por lo que iniciamos esta línea de trabajo. Así hemos estado en muchos campos diferentes.
- Como médico, inmunólogo de formación, ¿siempre tuvo claro que quería estar en un laboratorio?
- De pequeño quería ser biólogo, pero empecé la universidad en 1975, cuando aún no existía la investigación sobre ADN recombinante, ni la clonación de genes. La biología entonces me decepcionó mucho. Tenía 18 años y solo había taxonomía y anatomía, nombres en latín. Todavía me los sé todos (ríe). Así que me matriculé en la Facultad de Medicina y terminé ambas carreras. Estuve trabajando tres años con pacientes; mirando atrás, la formación médica ha sido muy importante para mí, porque sé cómo funciona el cuerpo humano y qué puede fallar, pero cuando se desarrollaron los anticuerpos monoclonales y la tecnología del ADN, volví al laboratorio. En realidad, como tenía la doble formación, me plantearon trabajar un año en el laboratorio, investigar y luego combinarlo con la parte asistencial. En ese año me di cuenta de que, aunque socialmente es mucho más agradable estar en una clínica que en un laboratorio -ya sabe, un médico tiene diez éxitos al día, mientras que un científico, si lo hace bien, tiene un éxito al año-, pero, en definitiva, creo que investigar era lo que mejor se adaptaba a mi personalidad. Si echo la vista atrás, fue una buena decisión. También podría haber fracasado.
- A la vista está que no. ¿Cuál sería su receta de éxito para quienes están empezando en la investigación?
- Para las personas que se inician en la ciencia, creo que lo más importante es ser valiente. Y laconfianza, también. Confiar en uno mismo, en las personas que colaboran contigo. Necesitamos un poco más de confianza ahora que hace unos años, pero hay que estar dispuesto a lanzarse, no hacer algo que ya está casi resuelto, sino ir al lugar que no conoces.
Ciencia y salud // elmundo